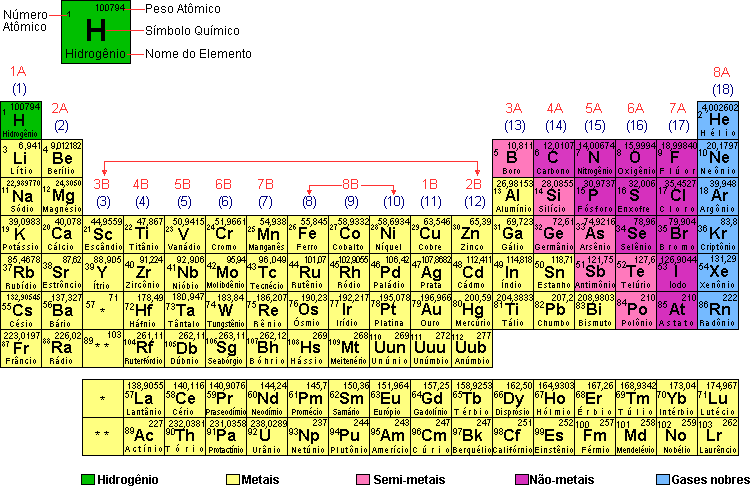
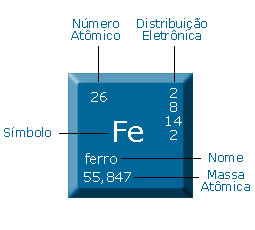
Você sabe o que é um átomo? A cadeira, o papel, a tinta das letras, o ar, as rochas, todos os seres vivos, os corpos celestes - Toda matéria do Universo é feita de
átomos.
Em 1897, o físico inglês Joseph John Thomson ( 1856-1940 ) identificou uma partícula de carga negativa chamada de
elétron. Mais tarde, outros cientistas descobriram os
prótons, que são partículas com carga positiva.
O modelo de Rutherford-Bohr foi modificado por outro cientista, o dinamarquês Niels Bohr ( 1885-1962 ), e, em 1932, o inglês James Chadwick ( 1891-1974 ) descobriu outra partícula atômica, o
nêutron.
A região onde estão os elétrons é na
eletrosfera, que tem um diâmetro muito maior que o do núcleo: o diâmetro total do átomo é cerca de 10 mil a 100 mil vezes maior do que o do núcleo.
Em certas situações, o átomo pode ganhar ou perder elétrons, deixando de ser neutro. Nesse caso, passa a ser chamar de
íon. Quando um átomo ganha elétron, ele fica com uma carga negativa, o íon formado passa a ser chamado de
ânion. Quando perde, fica com a carga positiva, já que fica com um próton a mais que o numero total de elétrons.